
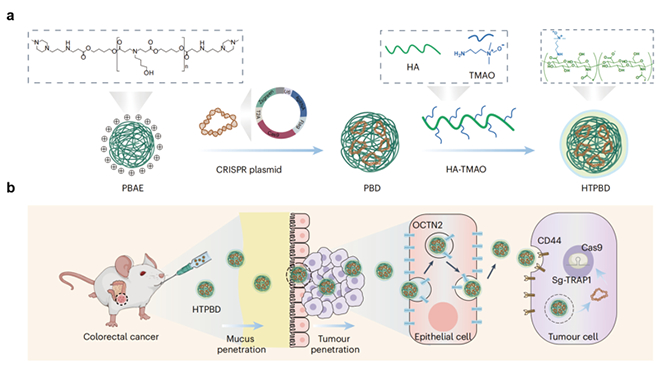
图 (a)基因编辑口服递送系统制备过程示意图;(b)口服递送系统实现结肠癌靶向基因编辑作用机理图
在国家自然科学基金项目(批准号:52333004、22135005)的资助下,武汉大学张先正教授团队在基因编辑口服递送系统的研究中取得进展,相关研究成果以“口服基因编辑纳米颗粒增强结肠癌化学免疫疗法(An orally administered gene editing nanoparticle boosts chemo-immunotherapy in colorectal cancer)”为题,于2025年4月23日在线发表于《自然•纳米技术》(Nature Nanotechnology)杂志上,论文链接:https://www.nature.com/articles/s41565-025-01904-5。
线粒体中的亲环素D(CypD)已被证实与多种炎症性疾病密切相关。在结肠癌中,高表达的肿瘤坏死因子受体相关蛋白1(TRAP1)与CypD形成稳定复合物,阻碍其向线粒体内膜易位并抑制下游炎症信号传导。因此,靶向抑制TRAP1为增强化疗敏感性提供了一种潜在策略。然而,现有小分子TRAP1抑制剂普遍存在线粒体靶向效率低、选择性差以及药代动力学特性欠佳等不足。相比之下,CRISPR/Cas9基因编辑系统具有短期给药即可实现长效调控的特性,结合结直肠癌患者依从性更优的口服给药途径,开发口服CRISPR基因编辑系统具有广阔的临床应用前景。然而,口服基因编辑系统仍面临多重挑战:首先,胃肠道内复杂的酶环境易导致核酸药物降解;其次,肠上皮紧密连接形成的物理屏障严重阻碍大分子药物吸收;此外,现有递送系统难以实现肿瘤组织特异性靶向,亟需突破性解决方案。
针对上述挑战,张先正教授团队证实敲除结肠癌特异性高表达的TRAP1基因可有效诱导CypD膜易位,显著增强化疗后的肿瘤坏死和免疫浸润。研究团队以多糖-两性离子聚合物(HA-TMAO)为外壳、以聚(β-氨基酯)(PBAE)为内核,成功构建了口服基因编辑递送系统HTPBD。该系统具备高稳定性(耐胃酸、肠酶)、优异的黏液扩散能力以及高组织渗透性和靶向性。此外,该系统还具备良好的冻干制剂适应性,有利于长期贮存运输。由于外层两性离子TMAO的水化作用,HTPBD可快速穿透黏液屏障,并通过有机阳离子转运体2(OCTN2)介导的转胞吞作用靶向富集于结肠癌组织。研究结果表明,HTPBD在多种结肠癌模型中成功重塑了化疗后的免疫微环境,展现出优异的肿瘤抑制效果,并显著增强了化学免疫联合疗法的治疗效果,具有重要的临床转化潜力,特别适用于免疫逃逸型或耐药型结肠癌患者。