
2025 年,南京大学在科研领域持续发力,据统计,该校本年度发表的影响因子高于 10 分的学术文献已达 93 篇。这些成果涵盖化学合成、神经科学、癌症免疫治疗、衰老与疾病机制、肝脏疾病及纳米生物医学等多个前沿领域,展现了其在基础研究与应用转化中的深厚积淀与创新活力。
仅 5 月前后,便有多项突破性研究分别登上Nature等顶级期刊,我们选了几篇优秀文章进行分享。
Nature
2025年5月28日,南京大学化学化工学院特聘研究员黄小强作为唯一通讯作者在全球顶级科研期刊 Nature 发表了题为“Electricity-driven enzymatic dynamic kinetic oxidation”的研究论文。
研究团队通过结合电催化与酶催化,成功开发出 ThDP 依赖酶的新催化能力,实现了醛到手性羧酸的动态动力学氧化新转化,该成果建立了 “电驱动酶催化” 不对称合成的新范式,为苯丙酸类药物的不对称生物合成开辟了新路径。

该研究聚焦于解决电化学与酶结合的局限性(此前主要复制已知酶功能,面临兼容性和异相电子转移难题),通过二茂铁介导的电催化对硫胺素依赖型酶进行改造,成功实现了 α- 支链醛的非天然动态动力学氧化。
这种电酶方法可高效生成多种具有生物活性的(S)- 洛芬类化合物,对映体过量最高达 99%;适用于过表达目标酶的全细胞体系,且酶的使用量极低(仅需 0.05 mol%)。
机制研究进一步揭示,改造后的电酶同时具备多重功能 —— 精准识别底物、加速外消旋化过程、促进动力学匹配的电子转移,为其高效催化提供了理论支持。
Nature Neuroscience
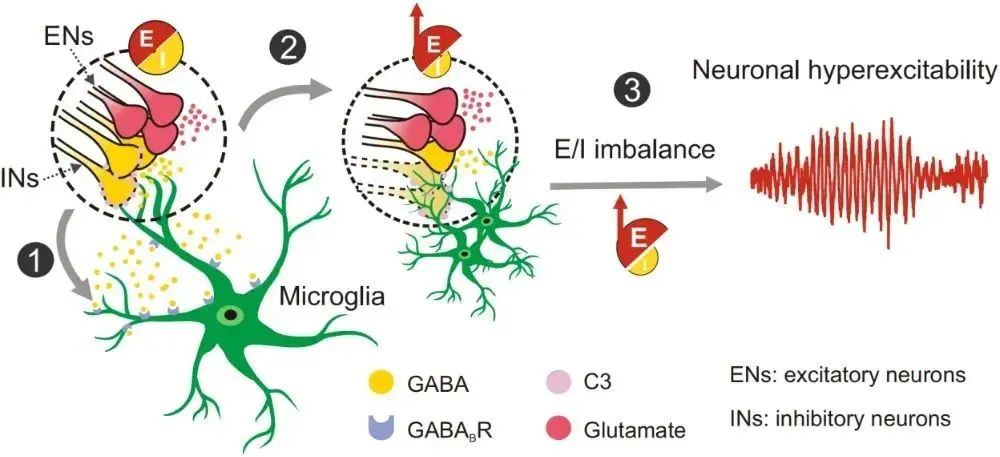
2025年5月27日,南京大学闫超教授、苏州大学丛启飞教授、南京鼓楼医院神经外科刘翔宇主任及浙江大学李新建教授团队在Nature Neuroscience(IF=20)在线发表题为“GABA-dependent microglial elimination of inhibitory synapses underlies neuronal hyperexcitability in epilepsy”的研究论文。
该研究系统揭示了癫痫病理状态下,小胶质细胞通过选择性“修剪”抑制性突触,引起兴奋/抑制失衡,进而促进癫痫疾病进展的分子机制。

神经元过度兴奋是多种神经系统疾病的常见病理生理特征。神经元 - 神经胶质细胞的相互作用是这一过程的基础,但其详细机制仍不明确。
该研究在小鼠癫痫模型中发现,癫痫发作时,抑制性神经元会释放大量GABA,这种本应起抑制作用的物质反而通过GABAB受体激活了小胶质细胞,像“信号弹”一样引导小胶质细胞靠近抑制性突触。同时,星形胶质细胞分泌的补体C3会给抑制性突触做“标记”,让小胶质细胞精准吞噬这些能平衡神经兴奋的“连接结构”。结果导致抑制性突触持续减少,大脑兴奋-抑制失衡加剧,癫痫症状加重;而阻断GABAB受体或补体C3,能减少吞噬、缓解症状。
研究团队进一步在癫痫患者的脑组织中验证了这一机制:患者大脑里的小胶质细胞同样对GABA更敏感、吞噬能力更强,且大量吞噬抑制性突触,与抑制性神经元的互动也更频繁。这一发现不仅清晰揭示了癫痫发生发展中神经元与胶质细胞的互作机制,还为开发靶向这类互作的新疗法提供了科学依据。
Molecular Therapy
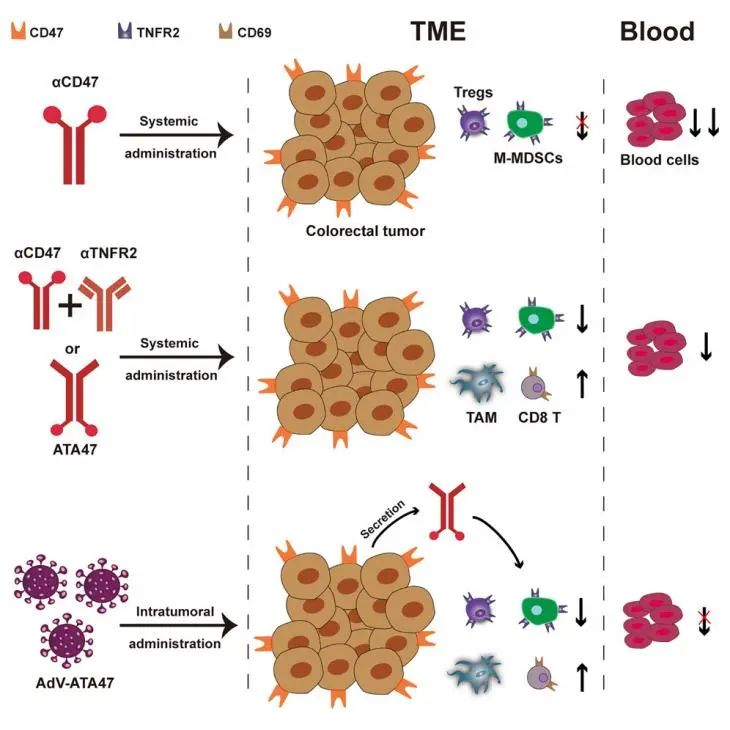
2025 年 5 月 30 日,南京大学魏继武团队在细胞与基因治疗期刊 Molecular Therapy(IF=12)在线发表了题为“Dual blockade of TNFR2 and CD47 reshape tumor immune microenvironment and improve antitumor effects in colorectal cancer”的研究论文。

研究团队创新性地提出了 “双靶点 + 局部递送” 新策略,设计出同时阻断 CD47 与 TNFR2 的双特异性抗体 ATA47——CD47 阻断恢复巨噬细胞吞噬功能,TNFR2 阻断减少免疫抑制细胞浸润,二者协同增强抗肿瘤免疫,且较传统联合治疗效果更优、副作用更低、给药简化。
进一步将 ATA47 基因整合至溶瘤腺病毒构建 AdV-ATA47,实现肿瘤原位递送,借助病毒优先感染肿瘤细胞的特性精准释放 ATA47,规避脱靶风险,激活 CD8⁺T 细胞与巨噬细胞形成协同免疫网络,为 CRC 免疫治疗提供更安全高效的方案,且有望与其他疗法联合提升治愈可能。
Nature Aging
2025 年 5 月 20 日,南京大学医学院附属鼓楼医院张韵研究员团队(陈华秋、冯艺佳为共同第一作者)联合温州医科大学老年研究院院长、瓯江实验室主任宋伟宏院士在 Nature Aging(IF=19.4) 上发表了题为“Activation of AMPK by GLP-1R agonists mitigates Alzheimer-related phenotypes in transgenic mice”的研究论文。
该研究发现,GLP-1 受体激动剂(GLP-1RAs)可通过激活 AMPK 信号,减少 Aβ 生成、抑制神经炎症并促进小胶质细胞对 Aβ 的吞噬,从而缓解 AD 模型小鼠的相关病理表型,揭示了 AMPK 在其中的介导作用,为 AD 治疗提供了新的潜在靶点和思路。

Hepatology
Hepatology ,山东第一医科大学脑科学与类脑研究院李子龙教授团队与南京鼓楼医院李婕主任团队、中国药科大学孔明副研究员合作在Hepatology (IF=15.8)发表了题为 “Pre-B-Cell leukemia transcription factor 1 contributes to liver fibrosis by enabling IL-7 signaling in hepatic stellate cells ”的研究论文。
该研究发现,转录因子 PBX1 在肝星状细胞(HSCs)激活中起关键作用:其表达受 Notch3 调控,通过激活 IL7R(IL-7 受体)促进 HSCs 向肌成纤维细胞转化,进而加剧肝纤维化;而 IL7R 可与 TGF-β 受体相互作用,放大促纤维化信号。实验证实,敲低 PBX1 或用抗体阻断 IL-7-IL7R 信号,均可在小鼠中减轻肝纤维化,且肝硬化患者中 PBX1、IL7R 与 HSCs 激活存在正相关,验证了这一机制的临床相关性。
该研究不仅揭示了肝纤维化进程中 “Notch3-PBX1-IL7R” 的新调控轴,还为肝纤维化的干预提供了潜在靶点(如 IL-7-IL7R 信号),为终末期肝病的防治提供了新的理论依据和实验基础。
Nature Nanotechnology
2025 年 2 月 18 日,南京大学叶德举教授、徐静娟教授团队在 Nature Nanotechnology(IF=34.9) 发表了题为 “Tandem-controlled lysosomal assembly of nanofibres induces pyroptosis for cancer immunotherapy ”的研究论文。

该研究针对现有焦亡诱导剂特异性不足、抗肿瘤免疫反应弱的问题,开发了一种肿瘤特异性纳米颗粒 NP-NH-D5。其核心优势在于:能响应肿瘤微环境的特定信号(细胞外基质金属肽酶 - 2 和细胞内还原剂),在肿瘤细胞溶酶体内完成电荷反转和形态转变(从纳米颗粒变为纳米纤维),从而精准破坏溶酶体,触发焦亡并引发强烈免疫原性细胞死亡,同时改善肿瘤免疫抑制微环境。
体内实验显示,NP-NH-D5 可有效抑制乳腺癌生长、防止转移和复发,且无全身副作用;更能增强 PD-L1 抗体在晚期转移癌和侵袭性胰腺癌中的疗效。该研究突破了传统焦亡诱导剂的局限性,为开发具有肿瘤特异性的 “刺激响应性” 焦亡诱导剂提供了新思路,有望推动精准癌症免疫治疗的发展。
从电驱动酶催化的全新合成范式,到癫痫发病机制的深度解析,从结直肠癌免疫治疗的创新策略,到阿尔茨海默病、肝纤维化的潜在干预靶点,再到肿瘤精准免疫治疗的纳米技术突破,这些成果为学科前沿探索提供了新视角,也为人类健康与社会发展贡献了 “南大智慧”。