
肝细胞癌(HCC)是一种原发性肝癌,起源于肝细胞,占所有肝癌病例的90%,其晚期患者对现有的酪氨酸激酶抑制剂和免疫检查点抑制剂等疗法响应有限。
随着代谢功能障碍相关脂肪性肝病(MASLD)的流行,脂肪变性HCC占比显著上升(近50%),因此亟需新的治疗策略。而铁死亡作为一种由铁依赖性脂质过氧化驱动的新型细胞死亡方式,近年来已成为癌症治疗的重要靶点。

2025年7月11日,香港大学黄泽蕾团队在 Journal of Hepatology (IF=33)发表了题为“Mevalonate pathway promotes liver cancer by suppressing ferroptosis through CoQ10 production and selenocysteine-tRNA modification”的研究论文。
该研究揭示,甲羟戊酸通路通过生成辅酶 Q10(CoQ10)和调控硒代半胱氨酸 - tRNA 修饰抑制铁死亡,进而促进肝癌发展,这一发现也为肝癌治疗提供了全新靶点。
铁死亡作为一种新型细胞死亡方式,已被认为是肝癌治疗的潜在新方向。肝癌细胞依赖谷胱甘肽 / GPX4 和 CoQ10/FSP1 这两套系统来抵抗铁死亡,而甲羟戊酸通路中的关键酶 MVD 可通过生成代谢物 IPP,同时调控 CoQ10 的产生和硒代半胱氨酸 - tRNA 的修饰,进而影响这两套抗铁死亡系统的功能。
研究团队发现,甲羟戊酸通路在肝癌中异常激活(如 MVD 高表达),而该通路通过影响 CoQ10 合成和硒蛋白(如 GPX4)翻译,直接参与肝癌细胞对铁死亡的抵抗。
因此研究团队聚焦于铁死亡与肝癌的关系,进而揭示甲羟戊酸通路的作用机制,为靶向治疗提供理论基础。

核心机制:甲羟戊酸通路的双重促癌作用
甲羟戊酸通路通过关键酶 MVD(甲羟戊酸二磷酸脱羧酶)发挥双重作用:
● 催化生成 IPP:MVD 将甲羟戊酸二磷酸(MVAPP)转化为异戊烯焦磷酸(IPP),IPP 既是 CoQ10 合成的前体,也是硒代半胱氨酸 - tRNA修饰的关键原料,CoQ10通过还原脂质过氧化物直接抑制铁死亡。
● 双重抗铁死亡效应:IPP 一方面促进 CoQ10 生成,增强脂质过氧化物清除能力;另一方面通过 TRIT1 酶催化形成 i⁶A₃₇修饰,保障 GPX4 等硒蛋白的翻译效率。
当 MVD 功能受抑时,IPP 生成减少会同时导致 CoQ10 水平下降和 GPX4 翻译障碍,双重削弱肝癌细胞的抗铁死亡能力,最终诱导铁死亡并抑制肿瘤进展。
关键实验结果验证
临床样本分析显示,62.7% 的肝癌患者肿瘤组织中 MVD 表达量较正常组织升高 2 倍以上,且 MVD 高表达与患者不良预后显著相关(TCGA 数据库及香港玛丽医院队列均证实)。空间转录组技术进一步证实甲羟戊酸通路在肝癌组织中特异性激活。

通过细胞实验和动物模型发现,敲低或敲除 MVD 后,IPP 水平下降直接导致 CoQ10 合成减少,同时 i6A37修饰受阻使 Sec-tRNA不稳定,导致 GPX4、TXNRD1 等硒蛋白翻译受抑制。
核糖体图谱显示,MVD 缺失会引起核糖体在 GPX4 的 UGA 密码子(硒代半胱氨酸插入位点)处停滞,进一步证实了翻译存在障碍。
此外,敲除 TRSP(编码 Sec-tRNA)或 TRIT1(催化 i6A 修饰)可直接阻断硒蛋白翻译,诱导铁死亡并显著抑制肿瘤生长及肺转移。
治疗策略探索
MVD 抑制剂 6-FMEV 通过竞争性抑制 MVD 活性,可降低 CoQ10 水平并阻碍硒蛋白翻译。在原位、皮下及脂肪变性肝癌模型中,均能有效诱导铁死亡,抑制肿瘤生长,即便存在 TP53 突变或 NRF2 过度激活等耐药背景也不影响其效果。
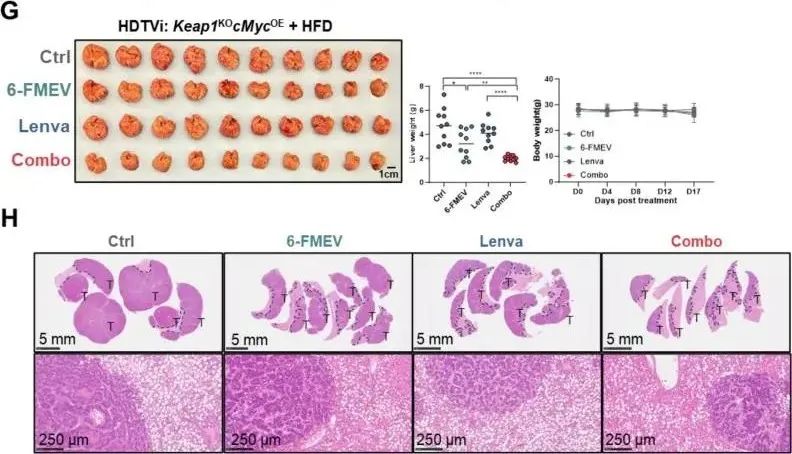
他汀类药物(如阿托伐他汀)则能抑制甲羟戊酸通路上游酶 HMGCR,产生与 6-FMEV 类似的效果,且与现有疗法协同增效。
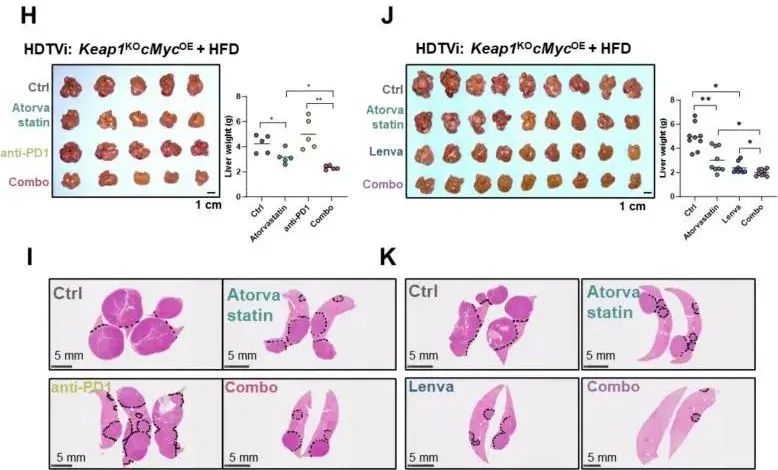
此外,6-FMEV 或他汀类药物与 TKI(如乐伐替尼)联合使用,可增强铁死亡诱导效果,克服 TKI 耐药,而他汀与抗 PD1 免疫治疗联合,能显著抑制脂肪变性肝癌,提升免疫治疗响应。
该研究为肝癌治疗提供了多重潜在策略:
靶向 MVD:MVD 抑制剂 6-FMEV 特异性强,可避免他汀类药物的肌毒性等副作用,适用于难治性肝癌(包括脂肪变性亚型)。
老药新用:他汀类药物成本低、临床应用广泛,其与 TKI 或 ICIs 的联合方案易于快速转化为临床治疗。
生物标志物指导:MVD 或 GPX4 的表达水平可作为生物标志物,筛选最可能从甲羟戊酸通路靶向治疗中获益的患者,实现个体化治疗。
未来,甲羟戊酸通路有望成为肝癌治疗的关键靶点,推动肝癌治疗模式的革新。