
胶质母细胞瘤(Glioblastoma, GBM)是最常见且最具侵袭性的原发性脑肿瘤,患者预后极差,中位生存期通常不超过15个月。近年来,越来越多的研究表明,GBM并非孤立存在,而是能够与周围神经回路发生密切互动,甚至整合入神经网络中,通过神经活性促进自身增殖与侵袭。
此前研究多聚焦于谷氨酸能信号在肿瘤进展中的作用,但对于其他神经递质系统(如胆碱能系统)如何参与调控GBM,尤其是长程神经输入的作用,仍知之甚少。
2025 年 8 月 18 日,陆军军医大学西南医院脑胶质瘤医学研究中心陈图南、卞修武、冯华、李飞、安徽医科大学王玉海等人在Cancer Cell (IF=44.5)发表了题为:“Long-range Cholinergic Input Promotes Glioblastoma Progression”的研究论文。
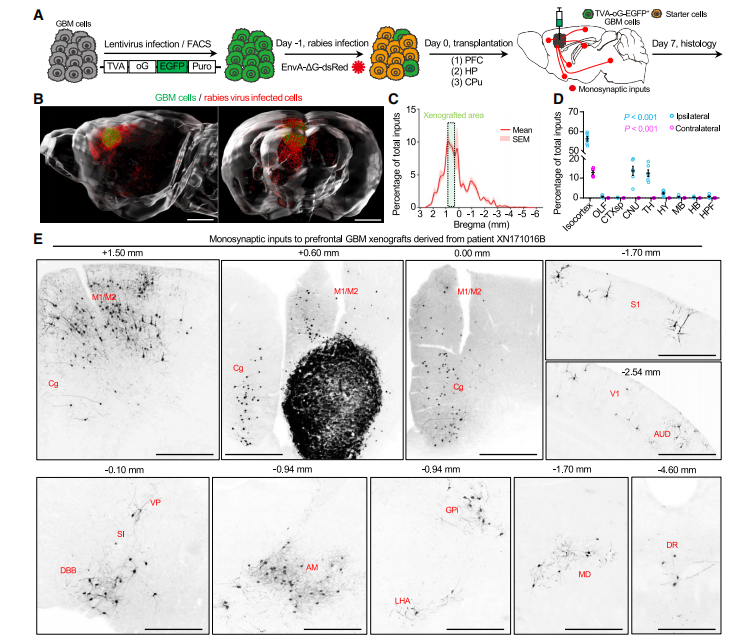
研究团队采用单突触狂犬病病毒追踪技术,在全脑范围内系统性地绘制了人源GBM移植瘤的神经输入图谱,揭示了其与局部及远距离神经元的连接模式。

这篇文章围绕 “神经元 - 胶质瘤相互作用如何影响胶质母细胞瘤(GBM)进展” 展开,研究思路遵循 “发现连接模式→验证功能作用→解析机制→探索临床转化” 的逻辑递进。
已知 GBM 可整合到神经环路中,局部谷氨酸能突触输入已被证实促进肿瘤进展,但神经元 - 胶质瘤连接的整体架构(尤其是远程神经环路和多样化神经递质系统的作用)尚不明确。基于此,研究聚焦于:GBM 与全脑神经元的连接模式如何?远程神经输入(尤其是神经调质系统)是否参与并影响 GBM 进展?
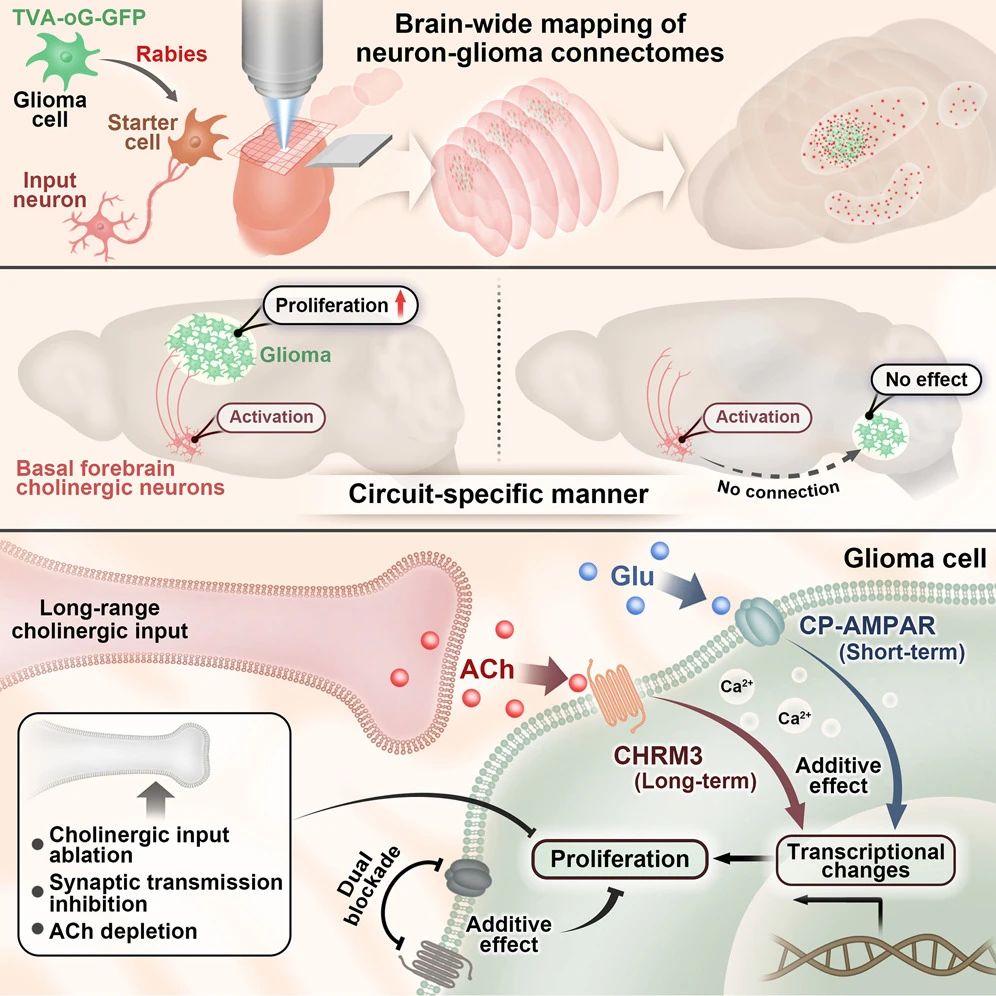
绘制全脑神经元 - 胶质瘤连接图谱
为解析神经元 - 胶质瘤的连接架构,研究采用单突触狂犬病病毒追踪技术,对移植到小鼠前额叶皮层、海马、尾壳核等不同脑区的患者来源 GBM 细胞进行全脑输入映射,结合 fMOST 全脑成像和分子标记分析,发现:
连接模式具有空间组织规律:局部输入以谷氨酸能神经元为主,远程输入来自皮层下核团,神经递质类型多样;
基底前脑胆碱能投射(如 Broca 斜角带核)是跨肿瘤位置和患者来源的保守性远程输入,为核心研究对象。
验证远程胆碱能输入与 GBM 的连接
在明确结构连接后,通过免疫电镜观察到基底前脑胆碱能轴突与 GBM 细胞间存在对称突触结构,符合胆碱能突触典型形态。
进一步的,光遗传学激活胆碱能神经元可引发 GBM 细胞持续钙瞬变,且该反应可被乙酰胆碱受体拮抗剂完全阻断,证实乙酰胆碱(ACh)介导的功能性连接。

解析胆碱能输入促进 GBM 进展的机制
针对 “胆碱能输入如何驱动 GBM 进展”,研究从受体、环路特异性、与其他信号的协同三方面探究:
关键受体鉴定:通过 CRISPR 敲除实验,发现仅敲除毒蕈碱受体 CHRM3 可抑制 ACh 诱导的 GBM 增殖,且 CHRM3 高表达与患者预后不良相关,证实 CHRM3 的必要性;
环路特异性:当 GBM 移植到无基底前脑胆碱能输入的延髓时,激活胆碱能神经元无法促进肿瘤生长,证实作用依赖直接神经连接;
与谷氨酸能信号的协同:钙成像显示 ACh 与谷氨酸可叠加增强 GBM 细胞钙瞬变,转录组分析发现二者在调控基因表达上存在时间差异(谷氨酸作用短暂,ACh 作用持久),提示非冗余协同机制。


探索临床转化潜力,验证治疗策略
基于机制研究,测试已获批药物的抗肿瘤效果,为临床应用提供依据:
毒蕈碱受体拮抗剂莨菪碱可抑制 GBM 生长,延长模型小鼠生存期;
乙酰胆碱酯酶抑制剂多奈哌齐(增加 ACh 水平)会加速 GBM 进展,提示临床需谨慎使用;
联合阻断胆碱能(莨菪碱)和谷氨酸能(perampanel)通路,或与标准化疗药替莫唑胺联用,产生叠加抗肿瘤效果,验证联合治疗的潜力。
综上,研究从 “结构连接” 到 “功能机制” 再到 “临床转化”,系统揭示了远程胆碱能输入在 GBM 进展中的作用,为靶向神经 - 肿瘤相互作用的治疗提供了新思路。